



DNA甲基化作为一种重要的表观遗传修饰,其在细胞分裂过程中的稳定传承对于细胞的功能和命运十分重要🧙🏽♀️。大量的研究工作表明DNA甲基化酶DNMT1在一个叫UHRF1的辅助因子的协助下,能定位到DNA复制叉,并以原有的DNA链为模板,将其DNA甲基化谱式拷贝到新合作的DNA链上,从而实现DNA甲基化谱式的稳态维持。但细胞是如何调控这一过程以保障DNA甲基化谱式的稳态维持的呢?
天美翁杰敏教授课题组张会芳和高芹芹经过一系列的研究发现🧑🏿:UHRF1和DNMT1在稳定性上受蛋白质甲基化酶SET8的调控🛴,SET8可以通过甲基化修饰UHRF1和DNMT1促进其泛素化修饰和蛋白酶体依赖的蛋白质降解。生科院廖鲁剑教授课题组通过质谱方法帮助鉴定了SET8催化UHRF1的甲基化位点为385位赖氨酸(K385)。同样通过质谱方法,北京蛋白质中心秦钧教授帮助鉴定了UHRF1的泛素修饰位点(K50,K500和K692)👩🏼。这些工作帮助她们最终确定SET8通过催化UHRF1的K385位点发生甲基化,从而促进UHRF1 K500位点的泛素化,进而导致了UHRF1经由泛素化途径降解。此外,她们的工作还发现赖氨酸去甲基化酶LSD1能够去除UHRF1和DNMT1的甲基化修饰,从而促进UHRF1和DNMT1蛋白稳定性。那么细胞中存在的这种对于DNMT1与UHRF1的稳定性调控是否会影响细胞整体的DNA甲基化的水平呢?通过对细胞整体DNA甲基化水平的检测,她们发现SET8蛋白通过促进DNMT1与UHRF1泛素化降解🦷,可以负控DNA甲基化。相反的👷🏽,去甲基化酶LSD1能够去除UHRF1与DNMT1的甲基化修饰来稳定DNMT1与UHRF1并且正控DNA甲基化🏃🏻♂️,表明对UHRF1和DNMT1的稳定性调控对DNA甲基化的精准传承和稳态调控具有重要意义。
值得一提的是,SET8本身是一个细胞周期调控的蛋白🍧,表现为DNA复制S期的低表达和有丝分裂期(G2/M)的高表达💁🏼♀️。这样的一个表达特点也使得UHRF1呈现在S期的高表达及G2/M的低表达。这种对UHRF1的细胞周期性调控是否具有生物学意义呢🏗?她们通过在G2/M期特异下调SET8发现下调SET8会导致UHRF1/DNMT1在在G2/M期增高和DNA甲基化水平的增加,提示在G2/M期下调UHRF1表达对于降低非S期DNMT1的甲基化酶活性🫰🏼,促进甲基化的精准调控具有重要意义。
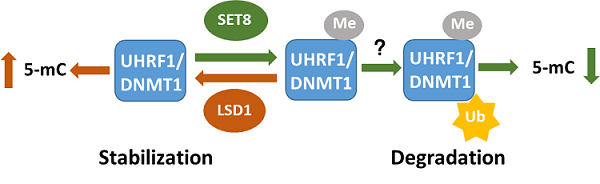
图注🏹:SET8与LSD1动态调控DNMT1/UHRF1甲基化依赖的泛素降解从而影响DNA甲基化的调控机制模型
该工作的一大亮点是发现负调控UHRF1/DNMT1活性对于DNA甲基化谱式稳态传承的重要性✫。虽然DNA甲基化的精准传承离不开DNMT1的维持性甲基化酶活性,但实际上DNMT1也具有一定的起始性甲基化酶活性🧑🏼🔧。因此😿👨🏻🦼,DNA甲基化的精准遗传不仅需要严格的维持DNA甲基化的保真度,还需要抑制DNMT1的起始性DNA甲基化活性。由于绝大部分的维持性甲基化都在S期完成,SET8在G2/M期对UHRF1蛋白水平的下调可以抑制DNMT1的起始性DNA甲基化活性, 促进DNA甲基化在遗传过程中的精准性。同时,该工作还证实DNA甲基化对UHRF1蛋白水平的改变比DNMT1更为敏感🗿,UHRF1是一个癌症治疗的重要靶点。
近日,该研究的相关论文《SET8 prevents excessive DNA methylation by methylation-mediated degradation of UHRF1 and DNMT1》已在SCI一区期刊Nucleic Acids Research(IF = 11.147)上在线发表。

翁杰敏教授课题组博士张会芳与已毕业的高芹芹博士为该论文的共同第一作者,华东师大为论文第一完成单位。该工作得到了院内外多个课题组的大力支持👩🏿🦳。该研究获得了国家自然科学基金、中国科技部等的经费支持。

图为论文共同一作:张会芳(左)高芹芹(右)