



肿瘤相关髓系细胞(TAMCs)是肿瘤免疫抑制微环境的重要组成部分。研究表明,阻断TAMCs介导的免疫抑制信号是克服肿瘤免疫治疗耐受的有效途径。然而,目前仍缺乏有效的TAMCs靶向干预策略。天美娱乐刘明耀教授/卢伟强研究员团队基于成熟的髓源细胞分化模型、基因修饰小鼠模型和生物信息学分析⚛️,发现前列腺素E2(PGE2)受体EP4在TAMCs中高表达👨🏽🦰,是介导TAMCs分化和免疫抑制的关键功能受体🚴。进一步的研究揭示了EP4受体在肿瘤微环境髓系细胞免疫功能调控中的全新作用机制,这极大地推动了EP4成为肿瘤免疫治疗领域的新兴潜力靶标。同时👩🏼💻,团队还提出了联合使用EP4拮抗剂和PD-1抗体克服肠癌免疫治疗耐受的新策略,为免疫治疗耐受肿瘤的治疗提供了新思路(EMBO Mol. Med. 2021, 13, e12798)。
目前🏄🏿♂️,临床上已有多个EP4小分子拮抗剂正在开展相关抗肿瘤研究🐗🧑🏫。以CJ-023423为代表的第一代磺酰胺(脲)类EP4拮抗剂受限于较差的理化性质,以及较差的成药性👨👨👦👦,如物种依赖性代谢倾向,低血脑屏障通透性,临床进展并不顺利;以E7046为代表的含苯甲酸药效团的第二代EP4拮抗剂,成功避免了磺胺基水解不稳定的特点*️⃣,有效地改善了化合物的理化性质和成药性。然而🤚🏻,临床试验结果表明✈️,E7046展现出有限的体内药物暴露,这预示着不太理想的生物利用度和临床抗肿瘤疗效。因此,开发具有高活性高成药性的新型EP4拮抗剂具有非常重要的基础研究意义和临床应用价值🥰。
团队基于前期搭建的高效GPCR药物筛选平台,结合骨架跃迁👻、构象限制、生物电子等排等经典药物设计策略进行多轮改造和筛选,发现和表征了两类1H-1,2,3-三氮唑衍生物(J. Med. Chem. 2020, 63, 569-590)和4,7-二氢-5H-噻吩并[2,3-c]吡喃衍生物(J. Med. Chem. 2022, 65, 7896-7917)🪩,作为EP4受体的新型小分子拮抗剂🈵,两类化合物均表现出良好的EP4拮抗活性和优异的亚型选择性,并通过重塑肿瘤免疫微环境✂️,有效减缓肿瘤的发展进程🫸。
基于前述开发高活性、高选择性EP4拮抗剂的良好基础,团队进一步重点关注对化合物成药性的优化。团队结合已报道的EP4受体晶体结构信息🗒🤵🏽♂️,利用成熟的分子对接技术,开展基于蛋白晶体结构的理性药物分子设计🔶,经过多轮改造和优化,成功获得了具有低nM水平EP4拮抗活性的先导化合物14(IC50 = 1.1 nM)🧘🏿♀️,与临床分子E7046(IC50 = 25.3 nM)相比,其活性提升超过20倍。化合物14展现出优异的亚型选择性,在多种GPCR药物筛选体系中均表现出良好的EP4受体拮抗活性🤵🏼♀️,且不存在种属局限性。此外,化合物14对多种CYP450酶均无明显抑制作用,并展现出优异的代谢稳定性✬,更优的口服生物利用度和良好的安全性。
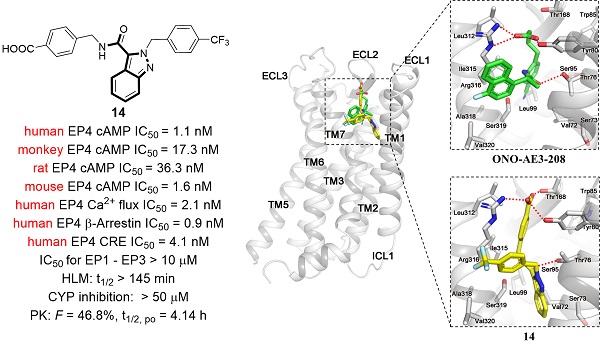
进一步研究发现🥳,化合物14能够强效抑制巨噬细胞中多个免疫抑制相关基因的表达。团队进一步构建了同源移植小鼠模型,发现口服化合物14能够有效逆转肿瘤微环境免疫抑制,增加CD8+ T细胞的浸润🪪,诱导强效的抗肿瘤免疫反应。即使在较低的剂量下,化合物14也展现出比临床分子E7046更优的抗肿瘤效果。更为重要的是🧑🏽🚒,化合物14可与PD-1抗体组合发挥协同抗肿瘤效果🕢,促进肿瘤消退。

该成果近期以“Discovery of 2H‑Indazole-3-carboxamide Derivatives as Novel Potent Prostanoid EP4 Receptor Antagonists for Colorectal Cancer Immunotherapy”为题在线发表在药物化学领域国际顶级期刊Journal of Medicinal Chemistry上,并被选为期刊主封面(Front Cover)。天美娱乐程志远博士和王义杰硕士为本论文的共同第一作者,刘明耀教授和卢伟强研究员为本论文的共同通讯作者。该研究得到了上海交通大学丁春勇研究员🙇🏽♂️,海南大学吴德燕教授,郑州大学杨琳琳教授以及本校张乾森研究员等合作伙伴的大力支持和帮助🚶♀️。

天美刘明耀教授/卢伟强研究员团队长期致力于研究GPCR在肿瘤发生发展中的功能与分子机理🤽♂️🔞,以及靶向GPCR的创新药物研发。团队积极与企业开展深度合作,代表性EP4拮抗剂已获批临床🦘🧙🏼♀️,正在针对晚期实体肿瘤开展临床I期试验🕉。