



食物为生命提供必需的营养物质↗️,是细胞生长、发育🐜、存活的关键。食物与免疫系统联系紧密。长期饥饿导致营养不良,会削弱免疫细胞的反应和执行能力,破坏黏膜屏障👩🏻💻,使机体更易遭受病原侵袭。有趣的是,优质🕗、足量的饮食对免疫系统同样弊大于利。工业化进程使得食物能够持续供应🍺,但肥胖症、免疫力低下👨🏭👩🏽🦳、自身免疫疾病的发病率反而居高不下。最新的研究表明✉️,间歇禁食或短期饥饿有助于优化免疫系统、提高免疫力💜、降低疾病风险💁🏻。然而⚠️,这种调控是高等动物在进化过程中独立获得的🦵🏽🧛🏿,还是代表了所有动物共同的生存策略◀️,目前仍不清楚。
自然界中,野生动物的食物完全依赖觅食获得,并随季节变化而波动,使得饥饿司空见惯♝。鱼类、两栖类🧑🏼、爬行类等动物甚至进化出强大的耐受饥饿的能力✫。同时,它们也会主动减少摄食以应对病原感染或环境突变。低等脊椎动物的这些行为,为了解通过饮食干预优化免疫这一生存策略的进化,提供了理想模型🧍🏻♀️。
近日,天美娱乐杨嘉龙团队在国际权威期刊Cellular and Molecular Life Sciences上发表了题为Dietary restriction to optimize T cell immunity is an ancient survival strategy conserved in vertebrate evolution的研究论文,揭示了饥饿双向调控鱼类T细胞免疫的分子机制♖☎️。

作者发现👩🏼🔧🧘🏿♂️,T细胞是罗非鱼免疫系统响应饥饿的主要应答者🦵🏿。长期饥饿导致脾脏萎缩、T细胞凋亡和自发炎症⛹️,损伤了免疫细胞稳态,使鱼类更容易遭受细菌感染。相反,短期饥饿可在不影响免疫细胞稳态的前提下🎅🏼🧜🏼♀️,提高T细胞应对抗原的激活和分化能力,增强抗感染免疫🧙。
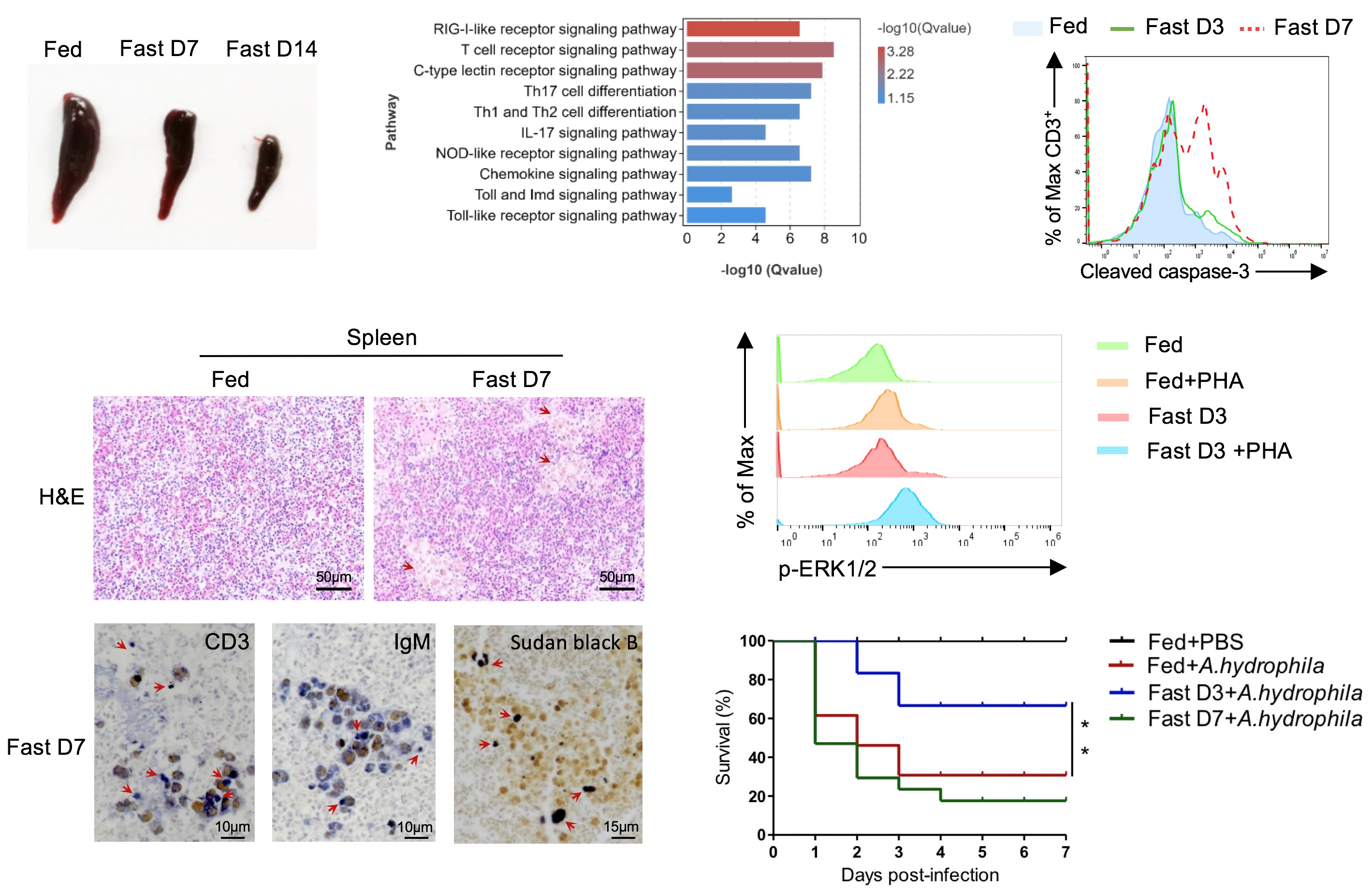
饥饿双向调控鱼类T细胞免疫
在机制上,饥饿诱发了T细胞自噬。而抑制自噬⚂,则损伤了T细胞的激活👨👧👧👨👩👦、增殖和免疫功能。随着饥饿时间的延长,T细胞自噬加剧;长期饥饿触发强烈自噬🧑🏿🎄,导致T细胞凋亡🫸🏻,破坏免疫细胞稳态。进一步的研究表明,饥饿通过生物能量枢纽AMPK通路介导T细胞的自噬☹️。阻断AMPK通路,不仅降低了T细胞的自噬水平🙍🏽♀️,造成免疫功能障碍👩🏿🌾,更损伤了T细胞在能量限制情况下维持存活的能力⛹🏻🧗♀️。实际上,细菌感染同样能够引发罗非鱼T细胞的自噬;而在短期饥饿的状态下遭遇感染🛀,能够将自噬窗口提前,加快T细胞的应答速度🏃🏻➡️,增强抗感染免疫能力,减少T细胞的凋亡🪅,并降低组织损伤🏋🏿。
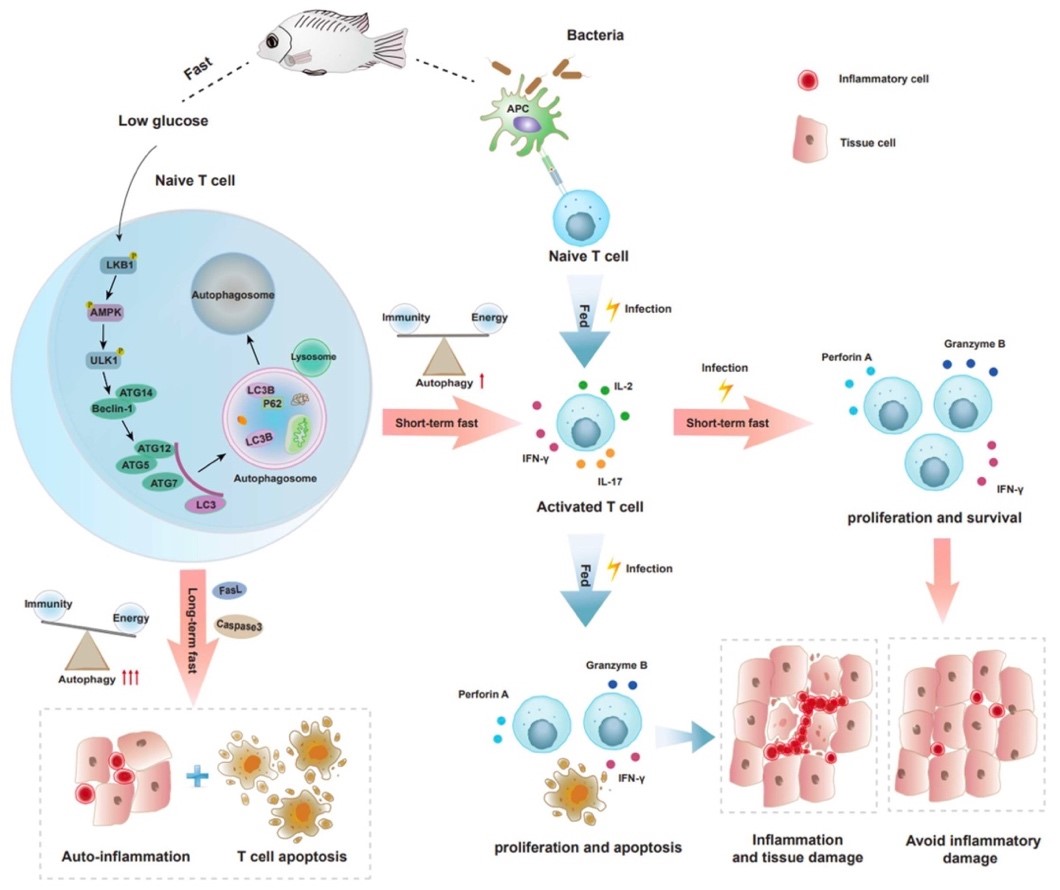
饥饿决定鱼类T细胞免疫的分子机制
综上所述🕰,本研究阐明了饥饿双向决定鱼类T细胞稳态和免疫的机制。在食物充足、病原感染的情况下🦍👨🏿💼,鱼类主动停止摄食,通过短期饥饿触发轻度自噬,增强T细胞免疫,维持免疫和能量平衡,体现了免疫优先的原则。而在食物匮乏的情况下🤾🏻♀️,长期饥饿迫使鱼类启动强烈自噬来回收能量,免疫系统也被牺牲🫙,从而在最大程度上保障生命延续👮🏻♀️,体现了生存优先的原则🤟🏼🧍🏻♀️。T细胞免疫与能量的权衡,代表了脊椎动物在长期的适应性进化中应对饥饿的生存策略🤷🏿👄。
天美娱乐李坤明博士、韦秀梅副教授、李康博士生为该论文的共同第一作者,杨嘉龙教授为本文通讯作者🌄。该研究受到国家自然科学基金优秀青年科学基金项目、面上项目等资助💥。

杨嘉龙教授(左)🧑🏽🎨、李坤明博士(右)
原文链接⌛️:https://link.springer.com/article/10.1007/s00018-023-04865-x